論文紹介LUCUBRATIONS
VT誘発試験と薬効評価

VT誘発試験と薬効評価
Programmed electrical stimulation of the heart in selection of antiarrhythmic drugs for sustained ventricular tachycardia.
満岡孝雄 橋場邦武
循環器科 第21巻 第5号 別冊
はじめに
心臓に起因する突然死は、米国においては年間35万人以上と推定され1)、そ のほとんどが心室頻拍(VT)が引き金となった心室細動(VF)によるものと考えられる2)3)。したがって、突然死の予防のためにはVTの確実な治療が必要とされる。一般的にVTに対する抗不整脈薬の選択は、一、二の薬物を経験的に選択し、投薬後の発作回数あるいはホルター心電図上のVT、あるいは心室性期外収縮(VPC)の減少によりその有効性を判定している。しかしながら、症例によってはVTおよびVPCの日差変動が激しく、薬物効果なのか自然変動であるのか判定が困難なことがあり、また、VPCが減少してもVTが抑制されないこともある。また、この方法では有効な薬物を見出すのに比較的長時間を要し、この間に突然死の危険性もありうる。
近年、VTに対するより正確な薬効評価を短時間に行う目的で、臨床電気生理学的検査中に、心臓電気刺激、すなわちprogrammed electrical stimulation (PES)によるVT誘発試験が行われるようになってきた。PESは、当初は発作性上室性頻拍の機序解明と薬効評価に用いられていたが4)、1972年Wellensら5)が、本法を反復性VTを有する5例にその機序解明を目的として初めて用いて以来、近年では、VTあるいはVFの既往のある症例にその治療方針を選択することを目的として行われるようになってきた6)7)8)9)。
Programmed electrical stimulation (PES)
VTを誘発するためのPESに関する標準化されたプロトコールは必ずしも確立されているとはいえない。各施設により、①刺激(強さ、パルス幅、電流のタイプ、基本周期の数および頻度、早期刺激の数および連結期)、②刺激部位、③刺激様式(単極か双極か)、④電極間距離などが、異なることが少なくなく、各施設間の成績の比較も客観的に行い難い。このような状況の中、1985年North American Society of Pacing and Electrophysiology (NASPE)は、VT症例に対するPESを含む臨床電気生理学的検査に関して標準的で最小限の指針を提案した10)。本稿ではこの指針に沿いながら、代表的と思われるPESの方法について述べる。
PESは、従来からのヒス束心電図を含む臨床電気生理学的検査 electrophysiological study (EPS)の一部として行われるために、その基本手技はEPS時のそれと同じである。手技について簡単に述べると、検査前にそれまで使用していた抗不整脈薬を、血中濃度半減期の少なくとも4倍以上の時間前から中止する。検査のために鎮静剤の投与は通常は行わない。リドカインによる局所麻酔下に、3〜4本の4極電極カテーテルを両側の大腿静脈より経皮的穿刺法により挿入し、レントゲン透視下で高位右房、三尖弁直下、右室心尖部に、それそれ右房、ヒス束、右室の電位記録および電気刺激のために留置する。通常の電気生理学的検査終了後に、PESによるVT誘発試験を行う。VTに対する抗不整脈薬の薬効評価は、具体的には投薬前にPESによりVTをまず誘発し、これを対照として投薬後にPESを同じ条件で繰返して行う。多剤について薬効評価が必要な場合は、1本の電極カテーテルを右室心尖部に留置、あるいは日をかえて経皮的に挿入し、薬効評価を繰返して行う。
PESによって誘発された心室性不整脈の定義は諸家によりそれぞれ異なることが多いため、ここではNASPEによって示された定義を表1にかかげる10)。なお、PESの適応となる症例は、通常は持続性VTと現時点では考えられているため、本稿ではとくに断らない限りVTは持続性VTを意味する。
表1 誘発された心室性不整脈の分類と定義
- Substaind ventricular tachycardia(持続性心室頻拍):30秒以上持続する、あるいは停止のために何らかの治療を必要とする心室頻拍
- Non-sustained ventricular tachycardia(非持続性心室頻拍):6拍以上30秒以内の心室頻拍(VT)で、自然停止し停止のための治療を必要としない
- Monomorphic ventricular tachycardia(単形性心室頻拍):少なくとも三つの誘導で、QRS波形が同一誘導では安定して同じである
- Multiple monomorphic ventricular tachycardia(多発性単形性心室頻拍):2種類以上のmonomorphic VTを同一患者に認める。pleomorphic VTは同義であるが用いない
- Pleomorphic ventricular tachycardia(多形性心室頻拍):どの誘導でもQRS波形が不安定で持続的にさまざまに変化する
- Ventricular fibrillation(心室細動):どの誘導でも明瞭に同定されるQRS波形が欠如している。しばしばsustained polymorphic VTとの鑑別が困難なことがある
- Single ventricular response:単一あるいは連続早期刺激により誘発された自然発生の単一心室性期外収縮
- Repetitive ventricular response:早期刺激により誘発された自然発生の2拍以上5拍以下の心室性期外収縮
1. PESプロトコール
早期刺激法extrastimulus methodが一般に広く用いられ、単一、二連続、および三連続早期刺激法が通常行われる。単一刺激法は洞調律より早い一定の刺激頻度で心室ペーシング(基本周期 basic cycle length= BCL, stimulus-stimulus= S1- S1= 500~800 msec)を8拍行い、第9拍目に早期刺激(S2)を加え、心室が有効不応期となるまでその連続期を漸次10〜20msecずつ短縮して、反復して行う。二連続早期刺激は、S1—S2間隔を心室の有効不応期より50msec長い間隔で固定し(のちにS1〜S2間隔も順次に40、30、20msecと短縮して固定し、以下のことを同様に繰返す)、第2拍目の早期刺激(S3)を漸次有効不応期まで10msecずつ短縮して行う。
刺激の強さは、通常2msecのパルス幅 値の2倍が用いられる。基本周期は、たとえば70/分、90/分、110/分と、少なくとも毎分20拍以上の差を有する周期を3種類選択する。130〜140/分以下の基本周期が通常は用いられる。
ペーシング部位としてはまず右室心尖部を選び、誘発されない時は次いで右室流出路で試みる。両部位で誘発に成功しない時は、isoproterenol負荷して後に右室刺激を行うか、あるいは左室刺激を行うか、症例のリスクと利益を十分に考慮した上で判断する。
早期刺激法でVTが誘発されない場合、5〜10連続刺激(burst刺激)を洞調律に近いペーシング頻度から、10/分ずつ毎分240の頻度まで、あるいは動悸などの症状が出現するまで増加し、VTの誘発を試みることもある。
VTの症例に対して心房(通常は高位右房)刺激が行われることもある。その方法は、①心房高頻度刺激:心房ペーシング頻度をWencke-bach型房室ブロックが生じるまで10/分毎に増加する。②心房単一早期刺激:心室のそれに準じて行う。心房単一早期刺激法でのVT誘発率は低く、心室単一早期刺激でのVT誘発例の13%とされ11)、一方では、心房刺激でVTが誘発される症例は、ほとんどが心室の単一早期刺激でVTが誘発される12)。このため通常は、VT症例では心房高頻度刺激はVT誘発よりも房室結節機能の評価のため行われることが多い10)。
2. PESによるVT誘発試験の問題点
一般的に早期刺激の数を増加するほどVTの誘発率が高くなり、感受性が増すが、一方では持続性VTの既往のない症例にも誘発されるようになり、その特異性は低下することが知られている。持続性VTの既往を有する症例での、PESにVT誘発率は80%前後とされているが、右室心尖部での2連続早期刺激までのプロトコールによりこのうちの70~90%が誘発され13)14)、3連続早期刺激を追加することによりVT誘発率は10~20%さらに高まる。しかしながら、一方では持続性VTの既往のない症例においても、多形性VTやVFの誘発率が2連続早期刺激まででは10~20%であったものが、3連続早期刺激を追加することにより10~30%さらに高まる13)15)。したがって、3連続早期刺激は、誘発されたVTが自然発作のVTとしばしば異なり非特異的であることから、持続性VTの既往のある症例にのみ限定するとの考えもある12)。Burst刺激法も3連続早期刺激と同様の理由から、持続性VTの既往のある症例にのみ時に用いられることもあるが16)、一方ではVT誘発のプロトコールには用いないとの考えかたもある17)。
右室心尖部以外の刺激部位を追加することによりVTの誘発率は高まることが知られている。Reddyら12)は、右室心尖部および流出路で2連続早期刺激までのプロトコールを用いてVTを誘発した80例中5例(6%)が右室流出路でのみ誘発されたと報告している。Robertsonら18)は、反復性持続性VTの既往のある118例において、右室および左室刺激によるVT誘発を行った。108例においてVTが誘発されたが、右室刺激では96例に、右室刺激では誘発されず、左室刺激でのみ誘発されたのは12例であった。左室でのみ誘発される理由として、左室での刺激部位がVTの回旋路により近いためと考えられている。左室刺激によりVT誘発率が高まることが考えられるが、一方では、塞栓症、心筋梗塞などの左心カテに伴うリスクが高まり、また、薬効評価のため数日にわたり左室刺激を繰返すことは難しく、薬効評価のための実際的な刺激法とはいいにくい。
Reddyら19)は、VTの既往がありVTが誘発されなかった11例のうち、isoproterenol点滴後に9例にVTを誘発し、isoproterenolによりVT誘発率が高まることを示唆しているが、isoproterenolの投与量については標準化されたものがなく、また、VTの既往のない症例に対するisoproterenolの効果、isoproterenolと抗不整脈薬の相互作用などについては十分に理解されていないので、薬効評価の際には用いないとしている12)。しかし、一方でFreedmanら20)は、VTの既往のない症例ではisoproterenol後でもVTが誘発されることはなく、isoproterenol後の誘発VTは自然発作のVTと同じで、薬物の効果も長期経口投与でも認められることから、isoproterenolを薬効評価の際にも用いることを勧めている。
3. 誘発VTと自然発作VTとの関係
PESによる薬効評価は、誘発VTは自然発作VTと同一のものであり、誘発VTに対する有効な薬物は自然発作VTに対しても有効であるころが前提となる。実際、反復性単形性持続性VTの症例では、誘発VTと自然発作VTとはほとんどの症例において類似していることが報告されている6)7)8)。しかしながら、一方では誘発VTは、自然発作VTとはQRS波型あるいは心拍数がしばしば異なることが指摘されている9)19)21)、Reddyら21)は、自然発作で反復性単形性持続性VTの既往がある18例にPESを行い、9例においてはQRS波形および心拍数ともに類似のVTを誘発できたが、残りの9例中2例には異なったQRS波型のVTを、7例には多形性VTを認めた。持続性VTの既往のある症例における、臨床的に証明されない多形性VTが誘発される頻度は5〜50%と諸家の報告により大きく異なる7)21)22)。
薬効評価
図1にPESによる薬効評価の実例をかかげる。症例は17歳男性で、2年前から月に1~2回運動時に動悸発作を認めるようになった。発作は突然に発症し、また突然に停止し、持続時間は長い時は2~3時間にも及ぶ、心電図で持続性VTが疑われPESを含めてのEPSを施行した。図1上段はdisopyramide投与前で、右室心尖部にBCL=400 msec、S1(V1)-S2(V2)=230 msecの単一刺激を与え、自然発作と同一のVTが誘発された。下段はdisopyramide 100mg投与後で、投与前と同一条件の刺激でもVTは誘発されず、S1(V1)-S2(V2)=250 msec、S2(V2)-S3(V3)=210 msecの二連続早期刺激でrepetitive ventricular responsesのみが誘発され、disopyramideの誘発VTに対する抑制効果が確かめられた。
図1 持続性VTの既往を有する17歳男性のPESによる薬効評価
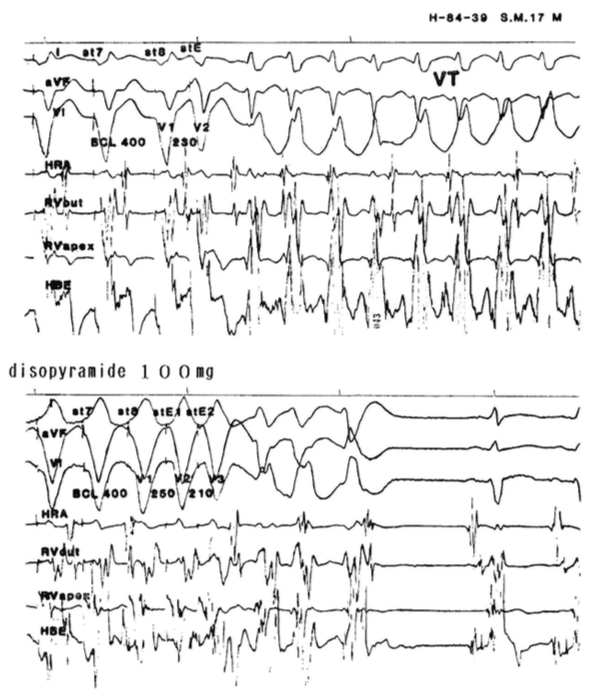 記録は各パネルとも、上から、I、aVF、V1の体表面心電図、および高位右房(HRA)、右室流出路(RV out)、右室心尖部(RV apex)、ヒス束(HBE)の各心腔内心電図を示している。上段のパネルは投薬前の対照で、基本周期(BCL)400msecで右室心尖部を8拍刺激した後に(図上には最後の2刺激がst7、st8−V1で示されている)、単一期外収縮(stE-V2)を与え、これに続いて右脚ブロック型の心室頻拍(VT)が誘発されている。下段のパネルには、disopyramide 100mg静注後で、投薬前と同じ条件の早期刺激ではVTは誘発されなかったために、2連続早期刺激(stE1、stE2)をst8-stE1=250msec、stE1-stE2=210msecの連結期で与え、その結果、3拍のrepetitive ventricular responseのみが誘発された。以上よりdisopyramideの誘発VT抑制効果が確認された。
記録は各パネルとも、上から、I、aVF、V1の体表面心電図、および高位右房(HRA)、右室流出路(RV out)、右室心尖部(RV apex)、ヒス束(HBE)の各心腔内心電図を示している。上段のパネルは投薬前の対照で、基本周期(BCL)400msecで右室心尖部を8拍刺激した後に(図上には最後の2刺激がst7、st8−V1で示されている)、単一期外収縮(stE-V2)を与え、これに続いて右脚ブロック型の心室頻拍(VT)が誘発されている。下段のパネルには、disopyramide 100mg静注後で、投薬前と同じ条件の早期刺激ではVTは誘発されなかったために、2連続早期刺激(stE1、stE2)をst8-stE1=250msec、stE1-stE2=210msecの連結期で与え、その結果、3拍のrepetitive ventricular responseのみが誘発された。以上よりdisopyramideの誘発VT抑制効果が確認された。
以上のようにPESによる薬効評価の実際はまず対照としてPESによりVTを誘発し、抗不整脈薬を投与後にPESを再度繰返してその効果を判定する。経口投与による評価しかできない薬物もあるが、一般的には短時間のうちに有効血中濃度を得ることができるために、静注法が薬効評価に用いられることが多い。薬物投与後のPESは、有効血中濃度が得られている時間内に行われることが必要である。このためPES中の薬物の血中濃度の測定が望ましい。
1.薬物の選択
PESの対象となる薬物の選択には、その症例における以前の抗不整脈薬の使用経験が参考にされるが、表2にかかげるVaughan‐Williamsに従った抗不整脈薬の分類により各群を代表する薬剤を1剤ずつ選択して行うことが多い。た とえば、IA、IB、本邦ではまだ治験の段階であるがIC、Ⅲの順でそれぞれの薬効を評価する。それで有効な薬物が得られないときには、IA+IBの併用などを考慮する23)24)。
| I群(Na channel blocker) | IA | quinidine |
| procainamide | ||
| disopyramide | ||
| IB | lidocaine | |
| mexiletine | ||
| diphenylhydantoin | ||
| tocainide*** | ||
| aprindine | ||
| IC | flecainide* | |
| propafenone* | ||
| encainide** | ||
| lorcainide** | ||
| Ⅱ群(β-blocker) | propranolol | |
| Ⅲ群 | amiodarone* | |
| bretylium** | ||
| sotalol** | ||
| Ⅳ群(Ca channel blocker) | verapamil |
**本邦では未だが治験段階でもない。
***本邦では治験中高率に薬疹を認めたため開発は中止された。
2.各薬物のVT抑制効果
IA群の薬物による誘発VTの抑制効果は10~50%と報告者により大きく異なる23)25)26)。IA群の薬物のうちprocainamideの抑制効果がもっとも強く45~50%で、quinidineおよびdisopyramideでは低く10~15%とされているが25)、quinidineおよびdisopyramideでもprocainamideと同等(34~41%)の抑制効果を認めるとの報告もある17)26)27)。誘発VTに対する抑制効果がない場合でもVTの心拍数を減少させ、VTによる血行動態の悪化を予防することで効果が認められることもある27)28)。PES時の誘発VTに対する薬物の効果と長期投与での自然発作VTに対する薬物の予防効果は、procainamideおよび quinidineではよく一致し、これらの薬物の長期投与下での自然発作VTの再発は5〜15%以下とされている12)23)25)。disopyramideの長期投与でも自然発作VTの再発は20%と高くはないが27)、しばしば高度の左室機能低下例では、その陰性変力作用のため心不全を合併し長期投与が困難なこともある27)。
IB群のmexiletineの持続性VTに対する抑制効果については未だ一定の結論には達していない24)28)29)。DiMarcoら28)は、従来から使用されているIA群の薬物、IB群のlidocaine、tocainide、diphenylhydantoin、II群のpropranololなどの薬物が無効であった、いわゆる薬物抵抗性VT35例にmexiletineを投与し13例(37%)でVT誘発が抑制され、長期経口投与でもVTの再発を認めなかったと報告している28)。一方Waspeら24)は、薬物抵抗性VT33例に mexiletineを投与し、3例(9%)でのみ誘発VTの抑制を認めている。
Flecainideなど、IC群の誘発および自然発作VTに対する抑制効果は未だ治験段階のため十分に明らかではない。Anderson30)は、薬物抵抗性VT15例にflecainideを投与し、9例(10%)において誘発VTの抑制効果を、2例においては誘発VTの心拍数の減少を認め、長期投与を行った10例のうち6例で自然発作VTを予防できたと報告している。
Propranololの誘発および自然発作VTに対する抑制効果は低いとされているが25)、propranololとquinidineまたはprocainamideとの併用は、おのおのの薬物の単独投与で誘発VTに対する抑制効果が得られなかった場合でも、しばしば有効であることが指摘され12)、長期投与でもVT抑制効果が報告されている7)。
III群の代表的な薬物でもあるamiodaroneは不応期を延長させることによって抗不整脈作用を発揮すると考えられるが、前述した、いわゆる薬物抵抗性VTの治療に非常に有効であることが示されている31)32)33)。しかしながら、PES時のamiodaroneの急性効果により長期投与時の効果を予知できるかについては一定の結論には達しておらず、今後の検討が待たれる32)33)。
表3にHorowitzら25)がまとめた反復性持続性VTに対するPESによる薬効評価の結果を示す。
表3 反復性持続性VTに対するPESによる薬効評価(文献23)より引用)
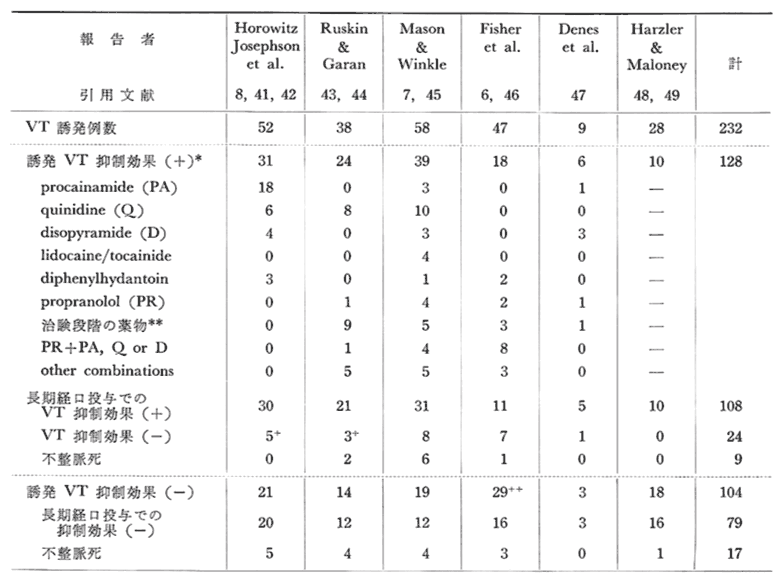 PESでVTが誘発された232例中128例(55%)で薬物による誘発VT抑制効果が認められ、このうち108例(84%)で長期経口投与でも自然発作VTの抑制が認められた。一方では、104例でPESにより有効な薬物が認められなかったが、このうち79例(76%)で長期経口投与中にTの再発を認めた。
PESでVTが誘発された232例中128例(55%)で薬物による誘発VT抑制効果が認められ、このうち108例(84%)で長期経口投与でも自然発作VTの抑制が認められた。一方では、104例でPESにより有効な薬物が認められなかったが、このうち79例(76%)で長期経口投与中にTの再発を認めた。*表には長期経口投与に用いられた薬物のみをかかげた。
**表2にかがげた抗不整脈薬のうちmxiletineは米国では未だ治験段階であるが、本邦で開発中止となったtocainideおよび治験段階のbretyliumはすでに一般で利用されている。
+ほとんどの症例で、PES時に有効とされた他の薬物でVTの再発は予防された。
++これらの施設ではPESによりVTが完全に誘発不能になった時に有効と判定している。このことが他の施設に比べPESにより有効な薬物が高率に認められなかった理由と考えられる。
3.薬効判定の基準
薬物投与後に、薬物投与前と同様のプロトコールでVTが誘発されなければ、誘発不能として薬物は有効であると考えられ、これによって判定した薬物は、通常長期経口投与でも自然発作VTの抑制効果があることが示されている7)8)22)24)。しかしながら、持続性VTは誘発されないが、repetitive ventricular responsesが誘発された場合、これを誘発不能とするか、あるいは部分的に有効とするかについては諸家により見解が異なる。Swerdlowら35)は、薬物後15連拍以下のVTしか誘発されなくなった場合に、これを誘発不能と判定しても、長期経口投与でのVT予防効果と一致すると報告しているが、症例が少ないためにさらに検討の余地がある。薬効の他の指標としては、早期刺激法でVTを誘発しうる連結期の幅、すなわちVT誘発zoneの短縮、あるいは心拍数の減少なども考慮されているが、その意義については十分に明らかではない。
4.薬物によるVTの悪化
多くの抗不整脈薬は一方では不整脈の増悪作用を有する36)37)。PES時の誘発VTに対する増悪作用は、非持続性VTが持続性VTとなる、VTがより少ない早期刺激で誘発される、VTの誘発zoneが拡大する、VTの心拍数が速くなる、VT時の血行動態の増悪を認める、などの場合がある。このような抗不整脈薬によるVTに対する増悪作用は、使用した薬物の種類によっても異なるが、PESで薬物評価を行った症例の20〜30%で認められる36)37)。PES時に認められた増悪作用が長期経口投与時にも認められるかどうかについては未だ十分な検討が行われていない。
5.PESによる薬効評価の利点と限界
PESによる薬効評価の利点は比較的短時間で有効な抗不整脈薬を選択できることである。VTが誘発された症例の約70%において、PESによる有効な抗不整脈薬の選択が可能であるが、残りの30%近くの症例においては有効な薬物が見出されない7)8)9)。もしも今後、PESによる薬効評価が無効である特定のVTの一群が同定されるならば、はじめから薬物以外の、たとえば電気的療法や手術療法が考慮されるようになる可能性もある。
一般にPESは、反復性持続性単形性VTが既往にある症例がその適応と考えられている。非持続性VTの症例に対してのPESの適応は、それらの症例に対する治療の必要性、必要とされた場合のPESの薬物選択に果たす役割が十分に明らかでないため、今のところ確率されていない38)。
PESは人為的に重症不整脈を誘発させるものであり、PESで誘発されたVTあるいはVFに対して電気ショックによる治療が30〜50%に必要とされ7)39)、また、表4に示すようなPESに伴う脂肪を含めての合併症の報告もある40)。したがって、その施行においては、検査に伴う緊急事態に直ちに対処できるように、不整脈に対する十分な経験のある人的および薬物、器具などの備えを有する施設に限られるべきであり、また、その適応も慎重に考慮される必要がある10)。
| 合併症 | 症例数 | 発生頻度(%、対PES) | 発生頻度(%、対症例) |
| 死亡* | 5 | 0.06 | 0.12 |
| 心臓穿孔 | 19 | 0.22 | 0.50 |
| 出血 | 4 | 0.05 | 0.10 |
| 血管損傷 | 8 | 0.10 | 0.20 |
| 静脈血栓 | 20 | 0.23 | 0.50 |
おわりに
以上述べてきたprogrammed electrical stimulationは、その安全性、長期経口投与での効果の一致、ホルター心電図などの他の検査法との優劣などの点において、いまだ確率された臨床検査法とはいいがたく、今後の研究成果が望まれる。
文献
- Kuller, L.M.: Sudden death: Definition and epidemiologic considerations. Progr. Cardio-vasc. Dis., 23: 1, 1980.
- Nikolic, G., Bishop, R.L. & Singh, J.B.: Sudden death recorded during Holter monite-ring. Circulation, 66: 218, 1982.
- Savage, D.D., Castelli, W.P., Anderson, S.J., et a1.: Sudden unexpected death during ambulatory electrocardiographic monitoring : The Framingham study. Am. J. Med., 74: 148, 1983.
- Wu, D., Wyndham, C.R., Denes, P., et al.: Chronic electrophysiological study in patients with recurrent paroxysmal tachycardia: A new method for developing successful oral antiarrhythmic therapy. In Reentrant arrhythmias (edited by Kulbertus, H.E.), University Park Press, Baltimore, 1976, p. 294.
- Wellens, H.J.J., Schuilenburg, R.M. & Durrer, D.: Electrical stimulation of the heart in patients with ventricular tachycardia. Circulation, 46: 216, 1972.
- Fisher, J.D., Cohen, H.L., Mehra,R., et al.: Cardiac pacing and pacemakers. II. Serial electrophysiologic-pharmacologic testing for control of recurrent tachyarrhythmias. Am. Heart J., 93:658, 1977.
- Mason, J.W. & Winkle, R.A.: Electrode-catheter arrhythmia induction in the selection and assessment of antiarrhythmic drug therapy for recurrent ventricular arrhythmia. Circulation, 58:971, 1978.
- Horowitz, L.N., Josephson, M.E., Farshidi, A., et al.: Recurrent sustained ventricular tachycardia. 3. Role of the electrophysiological study in selection of antiarrhythmic regimens. Circulation, 58:986, 1978.
- Ruskin, J.N., DiMarco, J.P. & Garan, H.: Out-of-hospital cardiac arrest: Electrophysiological observations and selection of long-term antiarrhythmic therapy. N. Engl. J. Med., 303:607, 1980.
- Waldo, A.L., Akhtar, M., Brugada, P., et al.: The minimally appropriate electrophysiological study for the initial assessment of patients with documented sustained monomorphic ventricular tachycardia. PACE, 8:918, 1985.
- Wellens, H.J.J., Bar, F.W., Fane, J., et al.: Initiation and termination of ventricular tachycardia by supraventricular stimuli: Incidence and electrophysiologic determinants as observed during programmed stimulation of the heart. Am. J. Cardiol., 46:576, 1980.
- Reddy, C.P., Chen, T.J. & Guillory, W.R.: Electrophysiologic studies in selection of antiarrhythmic agents: Use with ventricular tachycardia. PACE, 9:756, 1986.
- Brugada, P., Green, M., Abdollah,H., et al.: Significance of ventricular arrhythmias initiated by programmed ventricular stimulation: The importance of the type of ventricular arrhythmia induced and the number of premature stimuli required. Circulation, 69:87, 1984.
- Josephson, M.E., Marchlinski, F.E., Buxton, A.E., et al.: Electro physiologic basis for sustained ventricular tachycardia. In Tachycardia: mechanism, diagnosis, treatment(edited by Josephson, M.E., et al.), Lea & Febiger, Philadelphia, 1984, p.305.
- Buxton, A.E., Waxman, H.L., Marchlinski, F.E., et al.: Role of triple extrastimuli during electrophysiological study of patients with documented sustained ventricular tachyarrhythmias. Circulation, 69:532, 1984.
- Josephson, M.E., Horowitz, L.N., Spiel man, S.R., et al.: Electrophysiologic and hemodynamic studies in patients resuscitated from cardiac arrest. Am. J. Cardiol., 46:948, 1980.
- Prystowsky, E.N., Higer, J.J., Lloyd, E.A., et al.: Clinical electrophysiology of ventricular tachycardia. Cardiol. Clin., 1:253, 1983.
- Robertson, J.E., Cain, M.E., Horowitz, L.M., et al.: Anatomic and electrophysiologic correlates of ventricular tachycardia requiring left ventricular stimulation, Am. J. Cardiol., 48:263, 1981.
- Reddy, C.P. & Gettes, L.S.: Use of isoproterenol as an aid to electric induction of chronic recurrent ventricular tachycardia. Am. J. Cardiol., 44:705, 1979.
- Freedman, R.G., Swerdlow, C.D., Echt, D.S., et al.: Facilitation of ventricular tachyarrhy-thmias induction by isoproterenolol. Am. J. Cardiol., 54:765, 1984.
- Reddy, C.P. & Sartini, J.C.: Nonclinical polymorphic ventricular tachycardia induced by programmed cardiac stimulation: Incidence, mechanisms and clinical significance. Circulation, 62:988, 1980.
- Josephson, M.E., Horowitz, L.M., Farshidi, A., et al.: Recurrent ventricular tachycardia. 4. Pleomorphism. Circulation, 57:431, 1978.
- DiMarco, L.P., Garan, H. & Ruskin, J.N.: Quinidine for ventricular arrhythmias: Value of electrophysiologic testing. Am. J. Cardiol., 51:90, 1983.
- Waspe, L.E., Waxman, H.L., Buxton, A.E., et al.: Mexiletine for control of drug-resistant ventricular tachycardia: Clinical and electrophysiologic results in 44 patients. AM. J. Cardiol., 51:1175,1983.
- Horowitz, L. M., Josephson, M. E. & Kaster, J. A.: Intracardiac electrophysiologic studies as a method for the optimization of drug therapy in chronic ventricular arrhythmias, Progr. Cardiovasc. Dis., 23: 81, 1980.
- Waxman, H.L., Buxton, A.E., Sadowski, L.M., et al.: The response to procainamide during electrophysiologic study for sustained ventricular tachyarrhythmias predicts the response to other medications. Circulation, 67:30, 1983.
- Lerman, B.B., Waxman, H.L., Buxton, A.E., et al.: Disopyramide: Evaluation of electrophysiologic effects and clinical efficacy in patients with sustained ventricular tachycardia of ventricular fibrillation. Am. J. Cardiol.,51:759. 1983.
- DiMarco, J.P., Garan, H. & Ruskin, J.N.: Mexiletine for refractory ventricular arrhythmias: Results using serial electrophysiologic testing. Am. J. Cardiol.,47:131, 1981.
- Palileo, E.V., Welch, W., Hoff, J., et al.: Lack of effectiveness of oral mexiletine in patients with drug-refractory paroxysmal sustained ventricular tachycardia. A study utilizing programmed stimulation. Am. J. Cardiol.,50:1075., 1982.
- Anderson, J.L.: Experience with electrophysiologically guided therapy of ventricular tachycardia with flecainide: Summary of long-term follow-up. Am. J. Cardiol.,53:79B, 1984.
- Nademanee, K., Hendrickson, J.A., Cannon, D.S., et al.: Control of refractory life-threatening ventricular tachyarrhythmias by amiodarone. Am. Heart J.,101:759, 1981.
- Horowitz, L.N., Spielman, S.R., Greenspan, A.M., et al.: Amiodarone- ventricular arrhythmias: Use of electrophysiologic studies. Am. Heart J.,106:881, 1983.
- Waxman, H.L.: The efficacy of amiodarone for ventricular arrhythmias cannot be predicted with electrophysiologic studies. Int. J. Cardiol.,3:76, 1983.
- Horowitz, L.N., Spielman, S.R., Greenspan, A.M., et al.: Role of programmed stimulation in assessing vulnerability to ventricular arrhythmias. Am. Heart J.,103:604, 1982.
- Swerdlow, C.D., Winkle, R.A.& Mason, J.W.: Prognostic significance of the number of induced ventricular complexes during assessment of therapy for ventricular tachyarrhythmias. Circulation, 68:400, 1983.
- Poser, R.F., Podrid, P.J., Lombardi, F., et al.: Aggravation of arrhythmia induced with antiarrhythmic drugs during electrophysiologic testing. Am. Heart J.,110:9, 1985.
- Torres, V., Flowers, D.& Somberg, J.C.: The arrhythmogenecity of antiarrhythmic agents. Am. Heart J.,109:1090, 1985.
- Anderson, J.L.& Mason, J. W.: Criteria for selection of patients for programmed electrical stimulation. Circulation,73[Suppl.II]: Ⅱ-50,1986.
- DiMarco, J.P., Garan, H. & Ruskin, J.N.: Complications in patients undergoing cardiac electrophysiologic procedures. Ann. Intern. Med.,97:490, 1982.
- Horowitz, L.N.: Safety of electrophysiologic studies. Circulation, 73[Suppl.II]: Ⅱ-28,1986.
- Josephson, M.E.& Horowitz, L.N.: Electrophysiologic approach to therapy of recurrent sustained ventricular tachycardia. Am. J. Cardiol.,43:631,1979.
- Josephson, M.E.& Horowitz, L.N.: Unpublished data.
- Ruskin, J.N. & Garan, H.: Chronic Electrophysiologic testing in patients with recurrent sustained ventricular tachycardia. Am. J. Cardiol.,43:400,1979.
- Ruskin, J.K.: Personal communicaition.
- Mason, J.W. & Winkle, E.: Arrhythmic induction in patients with recurrent ventricular tachycardia: New findings. Circulation, 60:II-24,1979.
- Fisher, J.D., Mehra, R. & Furman, S.: Termination of ventricular tachycardia with bursts of rapid ventricular pacing. Am. J. Cardiol.,41:94, 1978.
- Denes, P., Wu, D., Wyndham, C., et al.: Chronic electrophysiologic study of paroxysmal ventricular tachycardia. Circulation,58:Ⅱ-155, 1978.
- Hartzler, G.B.& Maloney, J. D.: Programmed ventricular stimulation in management of recurrent ventricular tachycardia. Mayo Clin. Proc, 52:731, 1977.
- Hartzler, G. O.: Personal communicaition.



