論文紹介LUCUBRATIONS
QT延長症候群

特殊な背景に伴う不整脈
2. QT延長症候群
満岡孝雄
Practical Seminar 不整脈
比江嶋一昌編著 日本醫事新報社: 186-196, 1990.
QT延長症候群は、著明なQT延長、torsade de pointes(Tdp)と呼ばれる特殊な心室性頻拍あるいは心室細動、これらによる失神発作や急死などを特徴とする症候群である1)2)。QT延長症候群の原因は、表1に示すように遺伝性と二次性とに大別される。いずれの原因による場合でも上記のような臨床像は共通しているが、治療においては異なる点も少なくないため原因の鑑別は重要である。
表1 QT延長症候群の原因(文献10より引用・改変)
| A. 遺伝性QT 延長症候群 | 1. 遣伝型 | a. Jervell and Lange-Nielsen症候群 b. Romano-Ward症候群 |
| 2. 孤発型(特発性) | ||
| B. 二次性QT 延長症候群 | 1. 薬剤によるもの(表2参照) | |
| 2. 電解質異常 | a. 低カリウム血症 b. 低マグネシウム血症 c. 低カルシウム血症 | |
| 3. 中枢神経系障害 | a. くも膜下出血 b. 急性脳塞桂症・脳出血 c. 頭部外傷 | |
| 4. 高度徐脈性不整脈(特に完全房室ブロック) | ||
| 5. その他 | 急性心筋炎、僧帽弁逸脱症候群、心筋虚血/心筋梗塞、甲状腺機能低下症、人工ペースメーカー機能異常、急激な体重減少(低カロリー性食事療法very-low-energy diets、300〜400kcal/日、空回腸バイパス術、神経性食欲不振などによる) | |
遺伝性QT延長症候群
I. 不整脈を起こす背景
遺伝性QT延長症候群(以下本症候群と略す)は、遺伝性の持続的なQT延長、発作性の心室性頻拍性不整脈、これによる失神発作、急死などを特徴とする症候群である。狭義にはJervell and Lange-Nielsen 症候群とRomano-Ward症候群の2つを指す。また、心電図および臨床的にはこれらと同様の諸特徴を示しながら、遺伝関係が不明ないしは調査困難な孤発例も少数ながら認められ、これらも特発性QT延長症候群として本症候群に含めている。
Jervell and Lange-Nielsen症候群は、上記の諸特徴の他に先天性聾啞を伴う。遺伝形式は常染色体性劣性遺伝であるために、親子などの2世代にわたって出現することはきわめて稀で、通常は孤発または同胞発症に限られる。その頻度は稀で、失神発作や急死の発生は幼若な年齢のことが多く、本症候群の中でより重症なものと考えられる。
Romano-Ward症候群は先天性聾啞を伴わず、単純常染色体性優性遺伝であるために、それぞれの家系内で親子関係の縦の世代に連続して多発するのが特徴であり、理論的には家系内の半数の症例が遺伝子を継承伝播することになる。失神発作や急死の初発年齢は、主に若年者であるが性差が認められる。男性では殆んど10歳未満で発症し、20歳以降になると症状の軽快を認める例もあるのに対して、女性では10歳以降で発症することが多く、30歳以後の初発例も少なくない3)4)。
II. 不整脈が起こる機序
本症候群における不整脈発生の機序は必ずしも明確ではないが、主に動物実験の成績からの推論では、心室に対する左右の交感神経支配の先天的な不均衡のためとされている5)。すなわち、心室に対する交感神経支配は左右一様ではなく、右側は心室前壁領域に、左側は心室後壁領域に分布するとされているが、主として心望に対する右側交感神経の緊張低下により、心室に対する左側交感神経の相対的な優位状況が生じる。このため心室前壁領域において再分極過程の遅延が生じ、心室内の再分極過程の不均一性、すなわち心室不応期の部位差が大となってQTが延長し、同時に心室細動閾値が低下して心室の電気的な被刺激性が亢進する。このような状況では運動、感情興奮などにより突然の交感神経緊張が加わると、左右の交感神経支配の不均衡がさらに増強することになり、容易に重症心室性不整脈が発生すると考えられている。このほかに、本症候群の本質的な異常は細胞膜を構成するタンパク質の先天的な異常であり、これにより再分極過程の第3相で起きる細胞内カリウム流出が障害されQT延長がもたらされるとの考え方もある。
最近、Levineらはcesium chlorideの中毒量を用いてQT延長および心室性不整脈の本症候群に類似した実験モデルを犬で作製し、これらのQT延長および心室性不整脈はmonophasic action potential上のafterdepolarizationとtriggered activityに一致していたと報告した6)。
Monophasic action potentialとは、カテーテル電極を心内膜あるいは心外膜に接触させて記録した活動電位類似の波形で、この再分極過程は活動電位のそれとよく相関して変化することが知られている。また、triggered activityとは、活動電位の終末部付近あるいはその直後に生じた小さな脱分極性の膜電位変化(afterdepolarization)がその振幅を増加して閾値に到達した結果生じた自発興奮であり、これが反復して生じると頻拍となる。
従来から本症候群においては、右室のmono-phasic action potential上にいわゆる "hump" が認められることが報告されており、本症候群もafterdepolarizationとtriggered activityによって生じる可能性が示唆される。
III. 発生する不整脈の種類
本症候群におけるめまいや失神発作は、Tdpと呼ばれるきわめて特殊な重症の心室性頻拍によって生じる。通常の心室性頻拍ではR-R間隔やQRS波形は比較的揃っているのに対して、TdpではR-R間隔やQRS波形の変動が大きく、特にQRS波形は基線より上向きになったり下向きになったりして変動する。Tdpは多くの場合は自然停止するが、時に心室細動に移行し、急死を招くことも少なくない。
IV. 診断
本症候群の診断は、非発作時にも存在する著明なQT延長、以下に述べるような失神発作の特徴、さらに家系調査により比較的容易である。
本症候群の非発作時心電図所見は、著明なQT延長と奇異なT波が特徴的であるが、運動負荷によりこれらはさらに高度となり、時に1心拍毎にQT間隔とT波が著しく変動する所見(T波の電気的交互脈、electrical alternans)が認められることがある。
QT延長は、我々の施設ではBazettのQTc(QT/)で0.46秒以上としているが、施設によっては0.44秒以上を採用している。失神発作例では通常0.50秒以上を示すことが多い。
この他、本症候群では、安静時に洞性徐脈を示し、運動負荷にても心拍数が健常人ほど増加しない。また、運動負荷やValsalva試験にて、QT延長、異常T波の増悪、心室性頻脈性不整脈が誘発されるなどが報告されており、診断の参考となる。
本症候群の特徴的な臨床症状は、激しい運動や感情興奮を契機として生ずる数秒から20〜30秒間の比較的短い失神発作である。程度が軽い場合は、完全な失神には至らない失神感、めまい感、動悸などを訴えることもある。
家系調査は本症候群の診断上きわめて重要であるため、広汎にわたって行われる必要があるが、調査にあたっては患者側の立場を十分に理解した上で慎重に行われる必要がある。家系調査では失神発作や急死の有無を確認するとともに、運動負荷を含めた心電図記録を行い、QT延長、異常T波などの有無を明らかにする。
V. 不整脈発生の予知と治療の適応
本症候群における不整脈発生の予知は、本不整脈が急死に結びつく可能性があるため特に重要である。また、不整脈発生の可能性があると判断された場合には、種々の予防的治療を考慮しなければならない。過去に失神発作を有する患者は、急死の可能性が高いので治療の対象となる。また、心室性期外収縮やその連発が認められるQT延長例も、それらがTdpの引き金になる可能性があるため、治療の対象となる。
QT延長のみで、運動負荷やホルター心電図などでも心室性期外収縮が認められない症例では、初回発作が生じるまでは治療を行わずに、定期的な経過観察を行っている場合が多い。しかし、失神発作や急死が家系内に認められるQT延長例に対しては、たとえ心室性期外収縮が認められなくても予防的にβ遮断薬を投与すべきとの考え方もある7)。
我々も、急死が認められる家系において初回発作にて急死した1例を経験しているが、本例は1年前の心電図では正常QTであった。このことは、無症状のQT延長例でも失神発作や急死の危険があることを示している。一方、急死・失神発作を全く認めず、生涯QT延長のみを示す無症状家系の存在も知られている4)。失神発作や急死を有する家系は、無症状家系より重症と考えられるかもしれない。
VI. 治療
本症候群においてTdpによる失神発作が頻発している時には、心臓ペーシングを施行し、心室細動に移行した場合には直流除細動を行い、心室性期外収縮の抑制にはリドカインを用いる。イソプロテレノールは本症候群ではTdpをむしろ誘発する可能性があるため、また、IA群の抗不整脈薬もQTを延長するという点で禁忌と考えられる。
発作の予防のためには、β遮断薬が最も有効と考えられている8)9)。プロプラノロールを30mg/日から始め、効果、副作用をみながら、必要に応じて120mg/日まで増量し、なるべく長期間投与する。プロプラノロールは1日3~4回に分服する必要があるため、最近では1日1回投与ですむ長時間作用型のアテノロール(10~50mg/日、分1)が用いられることもある。β遮断薬による副作用として、洞性徐脈、倦怠感などが認められるが、特に本症候群では洞性徐脈を認めることがあり、これがβ遮断薬投与にて増悪することもあるので注意を要する。本症候群のQT延長に対するβ遮断薬の効果は症例により一定しておらず、また、QT延長に対す香効果と発作予防効果とは相関しないとされている9)
ジフェニルヒダントインは従来より本症候群の多くの例で用いられていたが、その発作予防効果については一致した見解がない。我々はβ遮断薬のみで発作予防効果が十分でない場合は、IB群の抗不整脈薬であるメキシレチン300~400mg/日を、心室性期外収縮の抑制とQT短縮を期待して併用しているが、症例によっては有効との印象を得ている。IA群の抗不整脈薬は、QT延長をもたらすために禁忌と考えられている。本症候群の失神発作は感情興奮などで誘発されやすいことから、鎮静剤あるいは精神安定剤の投与もすすめられている10)。
以上のように、発作予防に対してまずβ遮断薬を投与し、これのみで発作を抑えられない場合には、メキシレチンあるいは鎮静剤、精神安定剤を併用する。
以上述べた薬物療法が無効の場合には、左側星状神経節切除術が考慮されるが、その発作予防に対する長期効果については必ずしも一致した見解は得られていない。
発作予防のためのペースメーカー植込みによる心房あるいは心室ペーシングは、一般には効果がないと考えられているが、β遮断薬にて高度の徐脈を示す例においては考慮されることもある。
運動あるいは感情興奮などは特に本症候群の失神発作の誘因となることから、日常生活の中で避けることが必要である。めざまし時計、呼び鈴、電話のベルなど突然に大きな音を出すものを身の周りから除く。急に最大限の力を発揮しなければならないような運動は、特に危険度が高い。場合によっては家族に蘇生の方法を教育することも必要である。
VII. 症例
<症例1 Jervell and Lange-Nielsen 症候群>
図1には、我々が経験したJervell and Lange-Nielsen症候群の1家系を示した。12歳の姉と10歳の弟のいずれにもQT延長、先天性聾啞、失神発作を認めた。両親はQT延長や聾啞を示さないが、血族結婚であり、同胞発症例であることは、本症が常染色体性劣性遺伝であることを示している。
図1〈症例1〉Jervell and Lange-Nidlsen症候群(Mt家系)
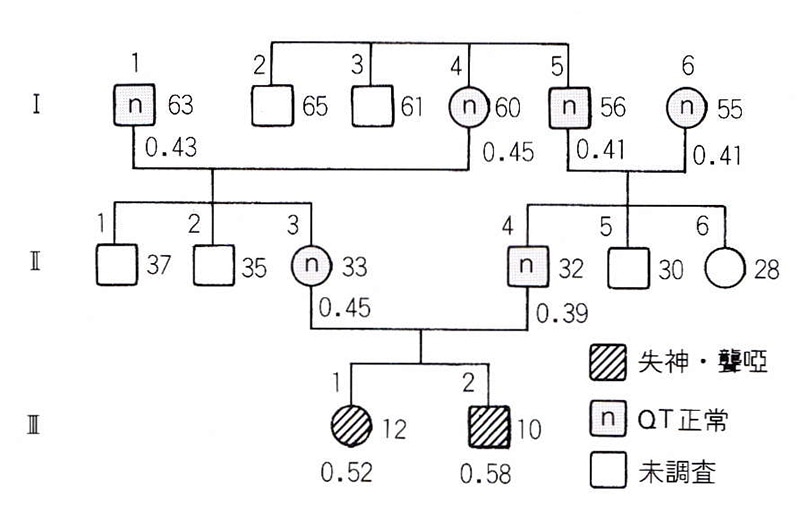
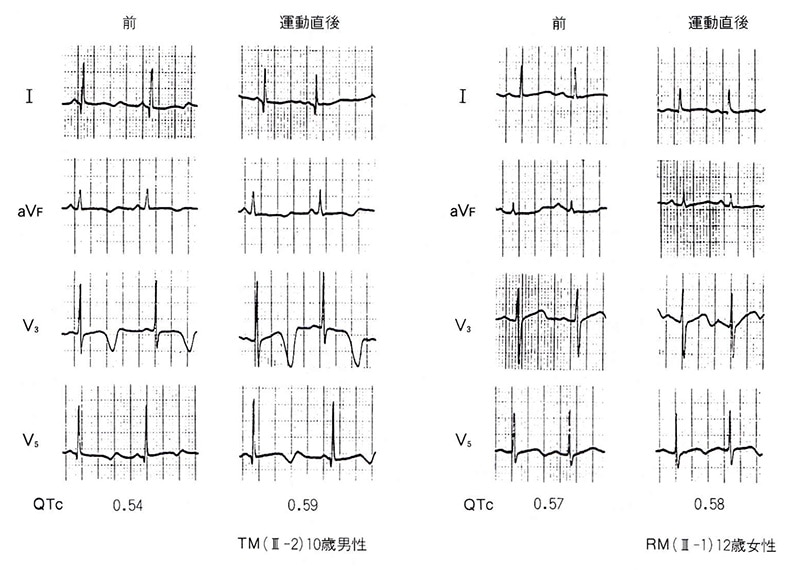
図2にはこの2例の心電図を示した。ともに著しいQT延長と異常なT波形を示しているが、運動負荷によってさらに著明になった。
図2〈症例1〉Jervell and Lange-Nidlsen症候群における運動負荷によるT波およびQT変動
<症例2 Romano-Ward症候群>
症例は23歳の女性で、本家系の発端者である。5歳頃、自動車を急に避けようとした時に失神発作を初めて起こした。以後も運動時、興奮時などに、動悸、めまい、時に失神発作を繰り返した。16歳、てんかんの診断のもとにジフェニルヒダントインを投与されて発作は軽減した。1967年、23歳で当科受診し、本症の診断がなされたが、翌年、テレビを自宅でみている時に急死した。
図3は本例のマスター運動負荷心電図で、負荷前よりQT延長を認めるが、負荷後はさらにQT延長は著明となり、同時にQT間隔とT波形が1心拍毎に著しく変動し、いわゆるT波の電気的交互脈が出現している。本心電図の最後の部分に比較的長い連結期で心室性期外収縮が出現しているが、本症ではこのような心室性期外収縮を契機としてTdpを起こすことが知られている。
図3〈症例2〉Romano-Ward症候群における運動負荷によるT波およびQTの変動(1)
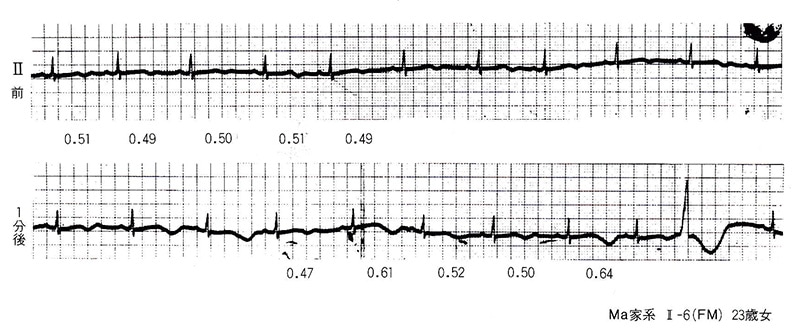
図4は本例の弟(13歳)の心電図である。著明なQT延長と奇異なT波形が認められ、運動負荷によりこれらはさらに高度となり、T波の電気的交互脈も出現している。この例は、授業中に教師から急に指名された時や運動中などに失神発作を生じ、精神科にて治療をうけていたが、15歳時に運動中に生じた4回目の失神発作のためにそのまま急死した。
図4〈症例2〉Romano-Ward症候群における運動負荷によるT波およびQTの変動(2)
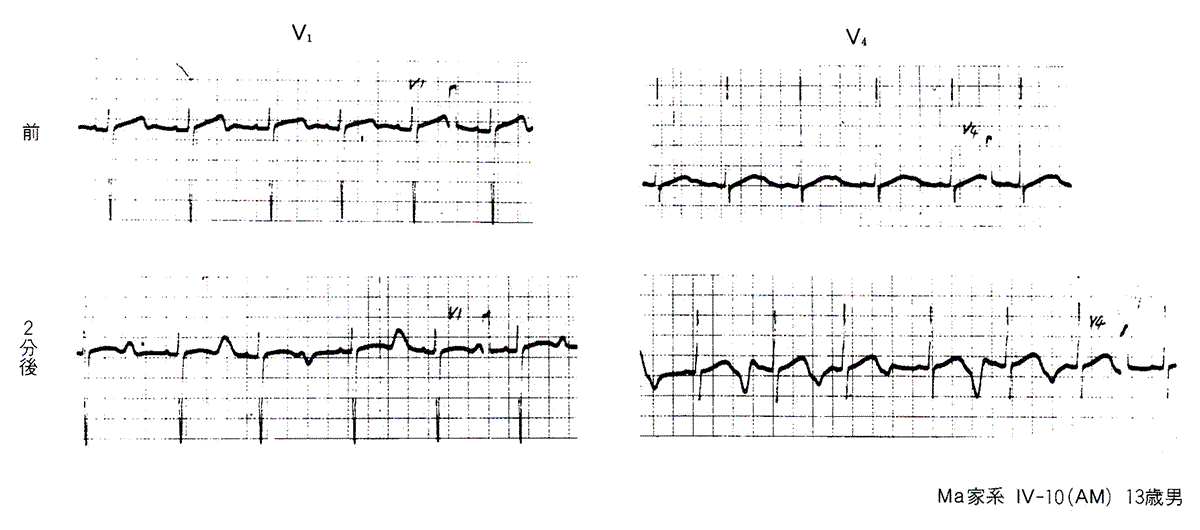
図5には、これらの例の家系図を示した。QT延長のみの例、QT延長と失神発作を有する例などが3世代にわたり多発し、本症が単純常染色体性優性遺伝であることを示している。
図5〈症例2〉Romano-Ward症候群(Ma家系)(1986年調査時)
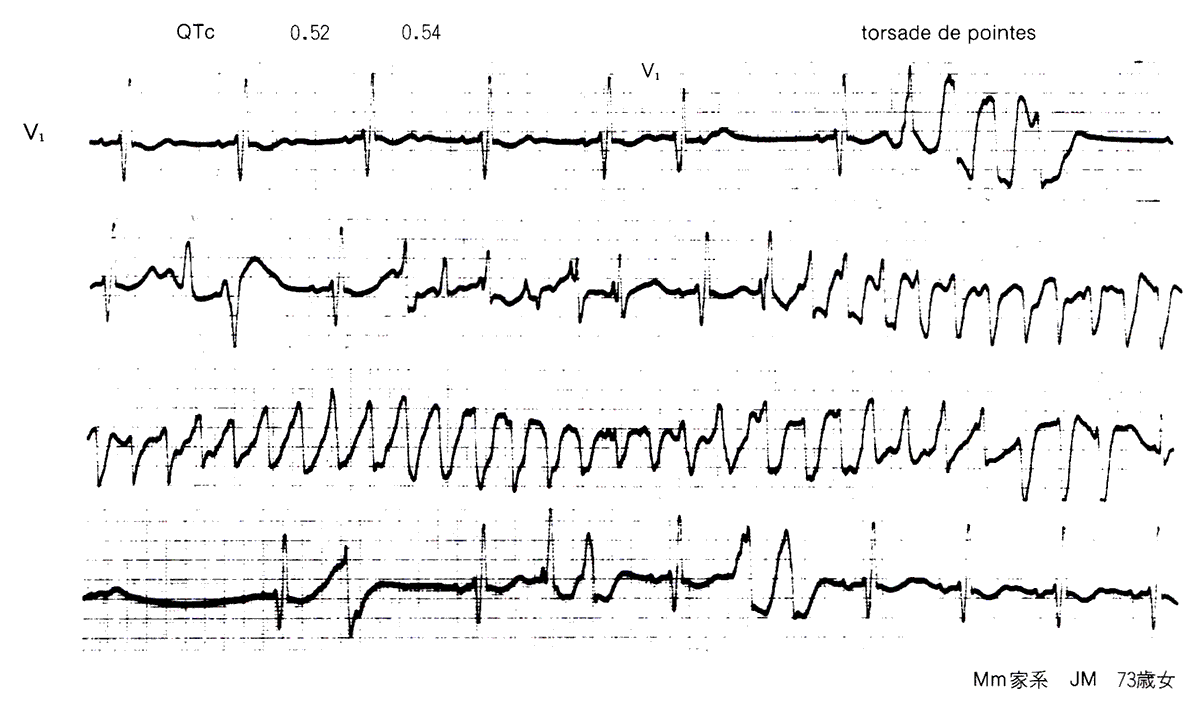
図6には、別の家系の1例の失神発作中の心電図を示した。QT間隔は0.52~0.54秒と著明に延長し、T波の比較的終末部近くに生じた心室性期外収縮に引き続いて、Tdpと呼ばれる特徴的な心室頻拍が発生している。
図6〈症例2〉Romano-Ward症候群(Mm家系)におけるtorsade de pointes
VIII. 長期予後
MossおよびSchwartzらは、特発性を含む本症候群の196例について平均26力月にわたり経過観察を行った結果、急死が4例(年間1.3%)、失神発作が27例(年間8.6%)に認められたと報告している7)。また、女性およびJervell and Lan-ge-Nielsen症候群では、失神発作や急死を起こしやすいとしている。
我々もRomano-Ward症候群の自験13家系131例について、平均7.2年にわたる長期経過観察を行った4)9)。その結果、観察期間中における急死は5例(年間0.5%)、失神発作は14例(年間1.5%)、QT延長のみで症状のない例が58例(44.3%)で、QT延長も症状も認めない例が54例(41.2%)であった。
MossおよびSchwartzらの頻度は、我々のそれより4~5倍高率である。この差は、彼らが先に述べたような広義の意味での本症候群の、しかも主として症状を有する症例を対象にしたのに対して、我々はRomano-Ward症候群に限定し、できる限り家系調査を行い無症状例を数多く加えたことによるもので、彼らの数値よりは真の頻度に近い値が得られたものと考えている。
二次性QT延長症候群
I. 二次性QT延長症候群を起こす原因
表1・2に二次性QT延長症候群(以下QTPSと略す)の原因を示しているが、この中で一般に認められるものは抗不整脈薬によるもので、他の原因によるものは比較的稀である。したがって、ここでは主として抗不整脈薬によるQTPSについて述べる。
表2 二次性QT延長症候群の原因となる薬剤(文献13より引用•改変)
| A. 抗不整脈薬 | 1. IA群 | キニジン プロカインアミド ジソピラミド アジマリン |
| 2. IB群 | アプリンジン | |
| 3.III群 | N-アセチルプロカインアミド アミオダロン ソタロール | |
| B. 血管拡張剤 | プレニラミン ベプリジル | |
| C. 向精神薬 | フェノチアジン系 三環系 炭酸リチウム | |
| D. その他 | プレドニゾロン フロセミド ケタンセリン(antagonist of 5-HT2-serotonergic receptor) アステミゾール(抗ヒスタミン剤) | |
キニジン、プロカインアミド、ジソピラミド、アジマリンなどのIA群、ソタロールやアミオダロンのIII群、その他べプリジルなどの薬物によって、QT延長、Tdp、これによる失神発作や急死などのQTPSが生じる。フェノチアジン系、三環系、炭酸リチウムなどの薬剤は、その電気生理学的特性がキニジンのそれと類似し、通常量でQT延長をもたらし、時にTdpを起こす。
II. 抗不整脈薬によるQTPSの機序
Rodenらは、犬のプルキンエ線維を用いた微小電極法による灌流実験で、低濃度のキニジン投与下に低カリウムとし、低頻度でのペーシングを行うと、常にearly afterdepolarization, triggered activityを誘発できることを観察して、キニジン誘発のTdpはtriggered automaticityによるものと推測している11)。しかし、薬剤によるTdpが異所性自動能、あるいはreentry, triggered activityのいずれによって生じるかは未だ見解の一致をみていない。
III.不整脈発生の予知と対策
キニジンは、抗不整脈薬によるQTPSの最も一般的に認められる原因の1つであるが、これによるQTPSについては、①殆んどが投与開始後数日で発生するが、長期投与中にも時に認められる、②QTPSを起こした時の血中濃度は半数が治療域あるいはそれ以下のレベルである、③QTPSの発症と血中濃度とは相関しない、などが報告されており、キニジン投与開始は、必ず入院中に行うことがすすめられている。
また、他の報告では、キニジンによるTdpが発生する状況として、①キニジンの血中濃度は一般に低い、②著明なQRS幅の増大は認めない、③低カリウム血症がしばしば認められる、④Tdpの発生直前にはいつも後述するような"long-short" sequenceが認められる、などがあげられている。薬剤の血中濃度とは無関係にQT-PSが生じてくる理由として、低カリウム血症などの薬剤とは無関係の因子が関与している、キニジンの代謝物が関与している、などの可能性があげられている。
プロカインアミドによるTdpは中毒量によって時に起こることはあるが、通常量では稀であり、静注よりは慢性の経口投与で起こりやすい。プロカインアミド自体による以外に、プロカインアミドは体内でN-acetylprocainamideに代謝され、これがQT延長とTdpの原因となることが報告されている。
一般に、抗不整脈薬投与中のどのような症例がQTPSを起こすかを同定することは容易ではないが、留意すべき事項として以下の諸点があげられている。
①治療前のQTcが0.44秒以上を示す例や投与後にQRS幅が25%以上に増大、あるいはQRSが0.60秒以上に延長する場合には、Tdpを起こす可能性が高くなる。しかし0.60秒以下でも多くの例がTdpを起こすので、QT延長の程度はTdpの適切な指標とはなりにくい、②有効な最少量を投与し、中毒量は避ける、③T波の電気的交互脈あるいは多形性心室性頻拍のshort runの出現はTdp発生の前兆である、④長い周期の後のT波にしばしばその形や高さの変化(postpause T wave changes)を認めたり、長い周期の後に短い連結期で、しかしR on Tほどは短くなく、T波の終末部周辺あるいはU波の上に心室性期外収縮が落ちる、すなわちlate-cycle VPC を伴う“long-short” sequenceの出現を認めることはTdp発生の切迫状況である。
IV. 治療
薬剤により生じたQTPSの治療として、①誘因となった薬剤を直ちに中止する、②80~120/分の刺激頻度で心臓ペーシングを行う、あるいはイソプロテレノール点滴静注(1〜4μg/分)により心拍数を90/分程度に増加させる、③電解質異常などがあれば補正する、④硫酸マグネシウム(1~2g)、リドカイン、メキシレチンなどの静注が症例によっては有効である、⑤繰り返すTdpや心室細動に移行した場合には、直流除細動の適応である、などがあげられる。
遺伝性QT延長症候群によるTdpでは、イソプロテレノールはTdpをかえって誘発しやすくする可能性があるため禁忌であるが、薬剤によるTdpには、イソプロテレノールは有効である。
Tdp型の心室性頻拍を認めた場合、Tdp発症前のQT延長の有無、QT延長が存在したならその原因が遺伝性か二次性かを鑑別することは、治療上きわめて重要である。緊急でQT延長の原因が明らかにされない場合は、心室ペーシングが最も安全で有効な治療である。
V. 症例
<症例3 ジソピラミドによるQTPS>
ジソピラミドによって生じたTdpの実例を示す12)。症例は57歳の女性で、洞性徐拍、洞房ブロックにより洞不全症候群と診断され、さらに2連発を含む心室性期外収縮が多発するためにジソピラミド300mg/日を投与された。約7力月後に、自宅玄関にて隣人と会話中に突然に失神発作をきたし当科に緊急入院した。観察室にて経過観察中、同様の失神発作を生じた。
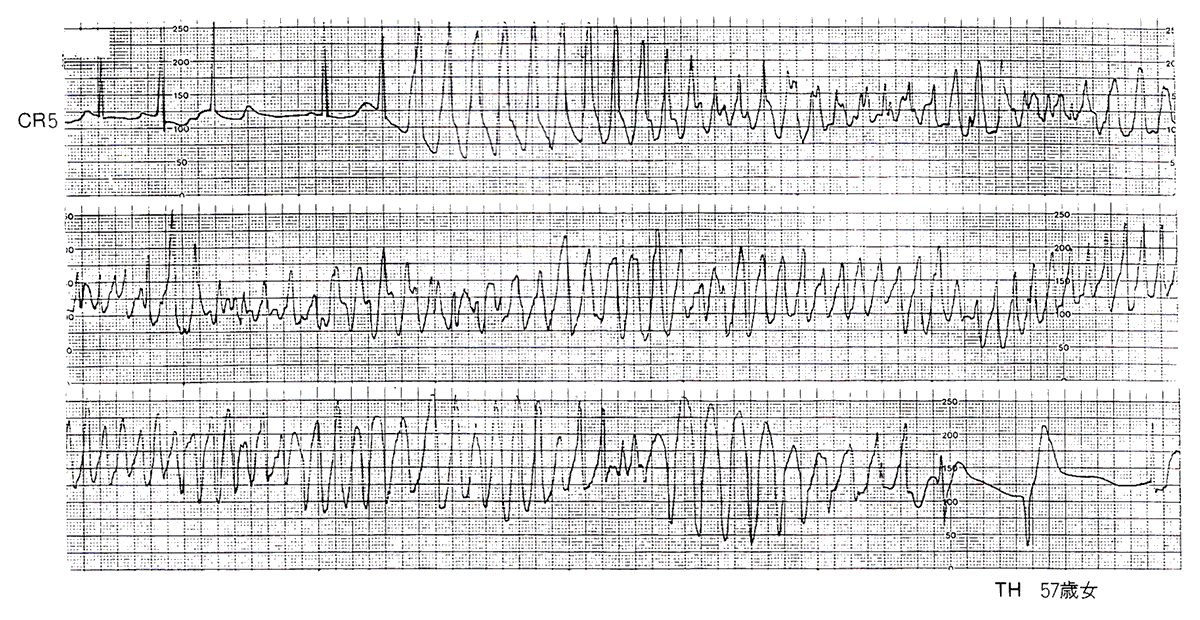
脈拍は触知不能で、この時記録された心電図が図7に示したものである。図7は典型的なTdpで、心室波は基線より上向きになったり下向きになったりしながら不規則に変動し、心拍数は毎分240ときわめて速くかつ不規則である。発作は35秒後に自然停止した。
図7〈症例3〉ジソピラミドによるtorsade de pointes
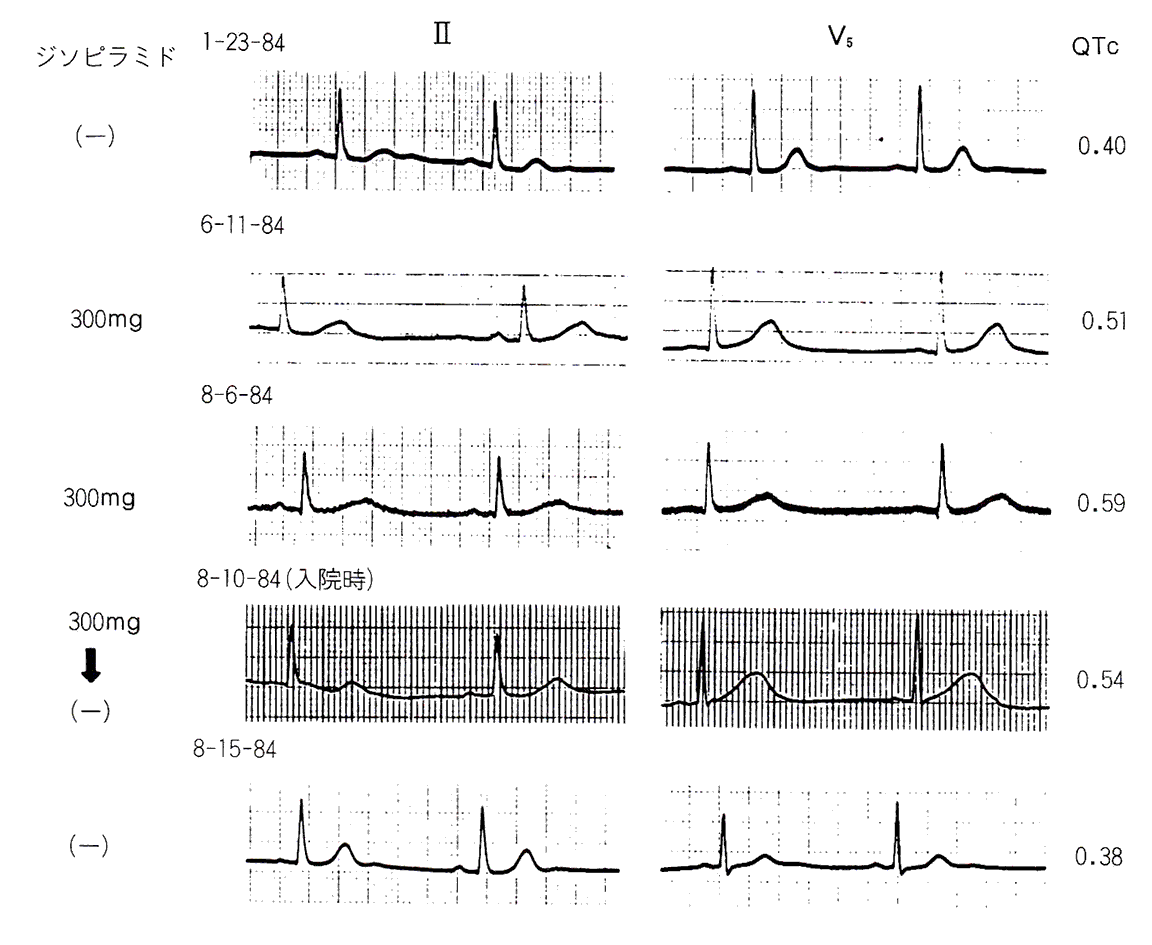
QTcの経過は図8に示すようにジソピラミド投与前0.40秒で、投与後より徐々に延長し、発作4日前には0.59秒と著明に延長していた。さらに発作の3日前に胃透視を行った後に下痢があり、当科入院時の血清カリウムが3.3mEq/1と低値を示した。本例はジソピラミドによる著明なQT延長に低カリウム血症が加わり、Tdpを生じたと考えられた。また、本例の洞性徐拍はジソピラミドによるQT延長を増悪させた可能性がある。
図8〈症例3〉ジソピラミド投与後のQTcの経過
<症例4 完全房室ブロックに伴うTdp>
図9に心房細動+完全房室ブロックに伴ったTdpを示す。症例は73歳の男性で、63歳より慢性心房細動、67歳時に完全房室ブロックとなり心拍数は40/分と低下した。人工ペースメーカー植込みをすすめるも自覚症状がないために拒否していた。73歳時、来客と昼食中に突然に失神発作を生じた。翌日入院し再び失神発作を生じたが、図9はその時の心電図で連続記録である。
図9〈症例4〉完全房室ブロックに伴うtorsade de pointes
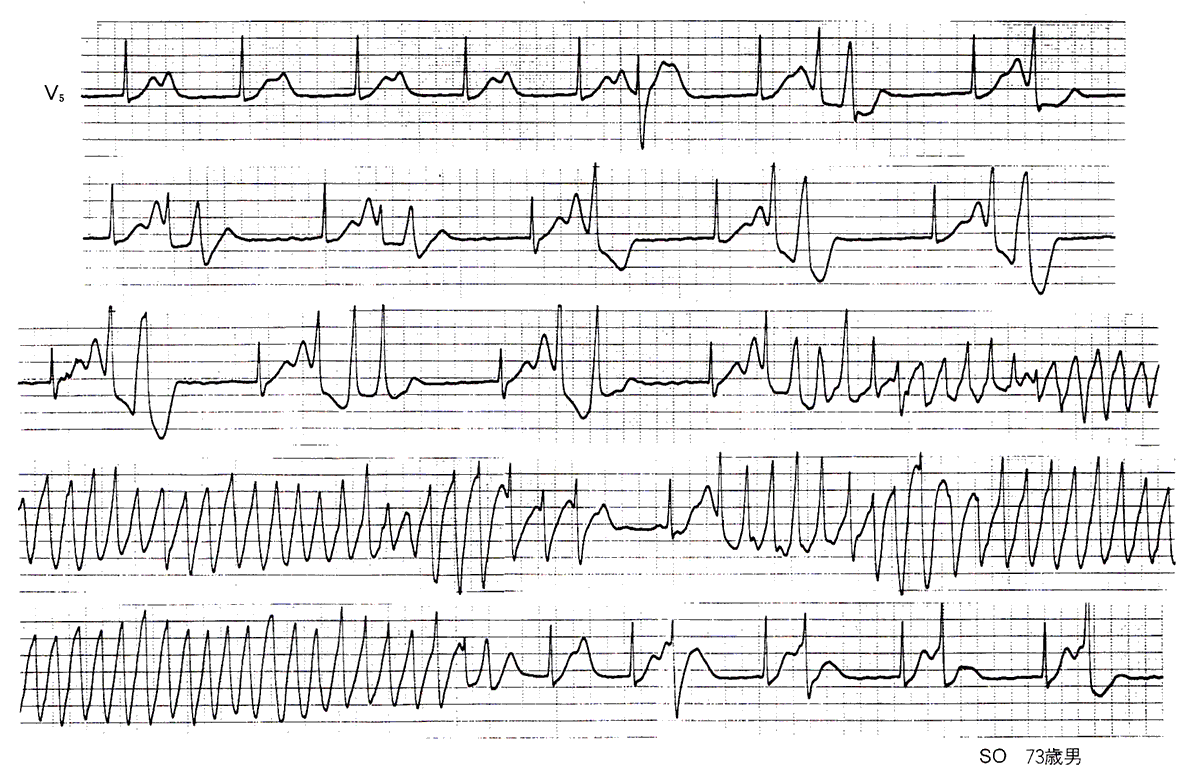
調律は心房細動+完全房室ブロックで、45/分の徐拍を示し、著明なQT延長と奇異な二峰性のT波を呈している。二峰性T波の後方成分は、徐々にその高さを増し、それに連れてT波の終末部付近に心室性期外収縮がはじめは単発で、次に2~3連発で出現し、ついには典型的なTdpが生じている。本例には直ちに心室ぺーシングを行い、これにより心室性期外収縮は抑制された。本例では入院時の血清カリウムが3.2mEq/1と低値で、これがTdpの誘因の1つになったと考えられた。低カリウム血症の原因は明らかではないが、高血圧症治療のために長期投与されていた利尿剤が関係した可能性がある。
最近、JackmanらはQT延長症候群をTdpの発生状況により、“adrenergic-dependent” QT延長症候群と“pause-dependent” QT延長症候群の2つに分類することを提唱している2)。
前者は、興奮や運動によるカテコラミンの増加によってQT延長が著明となりTdpが発生するもので、これには主として遺伝性QT延長症候群が相当するとしている。
後者は、長い周期の後に著明なQT延長とT波形の著しい変化が生じ、このT波(彼らはU波と考えているが)の終末部付近からTdpが発生するのが特徴で、これには抗不整脈薬などによる二次性QT延長症候群が主として相当すると考えている。
また、どちらのQT延長症候群もその発生メカニズムにはafterdepolarizationと、それによるtriggered activityが関係していると考えており、これらのメカニズムによりTdpの臨床像もよく説明できるとしている。提唱された新しい分類と発生メカニズムについての妥当性は今後検討される必要があるが、遺伝性と二次性のQT延長症候群を1つのメカニズムで説明する試みは興味が持たれる。
文献
- 満岡孝雄、橋場邦武: QT延長症候群. Annual Review循環器、杉本恒明、大島正浩、松本昭彦、杉下靖郎編集、P.105、中外医学社、1988.
- Jackman, W. M., Friday, K. J., Anderson, J. L., et el.: The long QT syndromes: A critical review, new clinical observation and a unifying hypothesis. Prog. Cardiovasc. Dis., 31: 115, 1988.
- Hashiba, K.: Some genetic analysis of the Romano-Ward syndrome. With special reference to the incidence of manifestations and its sex difference. Cardiac Arrhythmias: In Recent Progress in Investigation and Management, T. Iwa & G. Fontaine (ed.), p. 203, Elsevier science Publishers B. V., Amsterdam, 1988.
- Hashiba, K., Mitsuoka, T., Mori, M., et al.: The QT prolongation syndrome; Long-term follow-up study of 13 families with Romano-Ward syndrome. Heart and Vessels (Suppl.) 2: 2, 1987.
- Schwartz, P. J. and Locati, E.: The idiopathic long QT syndrome; Pathogenetic mechanisms and therapy. Eur. Heart J., 6 (Suppl. D) 103, 1985.
- Levine, J. H., Spear, J., Guarnieri, T., et al.: Cesium chloride-induced long QT syndrome; demonstration of afterdepolarizations and triggered activity in vivo. Circulation, 72: 1092, 1985.
- Moss, A. J., Schwartz, P. J., Crampton, R. S. et al.: The long QT syndrome: A prospective international study. Circulation, 71. 17, 1985.
- Schwartz, P. j.: Prevention of arrhythmias in the long QT syndrome. In Medical Management of Cardiac Arrhythmias, H. E. Kulbertus (ed.), p.153, Churchill Livingstone, London, 1986.
- 橋場邦武:QT延長症候群. 日内会誌、76: 993, 1987.
- Bhandari, A. K. and Scheinman, M.: The long QT syndrome. Mod. Concepts Cardiovasc. Dis., 54: 45, 1985.
- Roden, D. M., Hoffman B. F.: Action potential prolongation and induction of abnormal automaticity by low quinidine concentrations in canine Purkinje fibers. Relationship to potassium and cycle length. Circ. Res., 56: 857, 1985.
- 岡野容子、満岡孝雄、植山千秋、北野幸英、他: Disopyramideの長期投与中に下痢を契機としてtorsade de pointesを生じた洞不全症候群の1例. 心電図、9: 471、1989.
- Stratmann, H. G., Kennedy, H. l.: Torsades de pointes associated with drugs and toxins: Recognition and management. Am. Heart 113: 1470, 1987.



